一(yī)、原研藥與仿制(zhì)藥
藥物(wù)的(de)研發一(yī)般分(fēn)為(wèi)原研藥和(hé)仿制(zhì≠₹)藥。原研藥的(de)範圍一(yī)般包括:(1)針$ 對(duì)新靶點或已知(zhī)靶點設計(jì)的(de)完全創↔ σ新的(de)新藥(First-in-class♥×π>);(2)針對(duì)已知(zhī)靶點設計(jì)的(de)與已經存在藥物(wù)結構不(•☆bù)同的(de)新藥(Me-too,Me-better,Best-in-class)↑₩₹。仿制(zhì)藥則是(shì)對(duì♠↕)原研藥的(de)主要(yào)成分(fēn)進行(xíng)複制(zhì),與原研藥在質量、ε£¥©安全性和(hé)有(yǒu)效性方面都(dōu)相(xiàng)似的(de)©↓一(yī)類新藥。

1、原研藥
原研藥直白(bái)一(yī)點來(lái)說™β₹(shuō)就(jiù)是(shì)“正版藥”,指的(de)××就(jiù)是(shì)原創性的(de)、自(zì)主開(kāi)發的(de)、新的(de)藥₩β±品,由擁有(yǒu)藥品專利權的(de)企業(yè)進行(xíng)生(s<φ₩hēng)産。原研藥經過對(duì)成千上(s≤✘±&hàng)萬種化(huà)合物(wù)層層篩選和(hé)嚴格的(de)臨床試α±驗才得(de)以獲準上(shàng)市(shì),一(yī)般從(cóng)研發≤×到(dào)最後注冊上(shàng)市(s>∞&hì)的(de)時(shí)間(jiān)大(dà)約長(cháng)達10至15≈ 年(nián)之久,耗資更是(shì)數₹↓(shù)億美(měi)元而且成功率隻有(yǒu)10%左右。這(zhè)類藥在專利過期之前不♥ (bù)可(kě)被仿制(zhì),并且享受單獨定價等♦→↕政策的(de)保護。
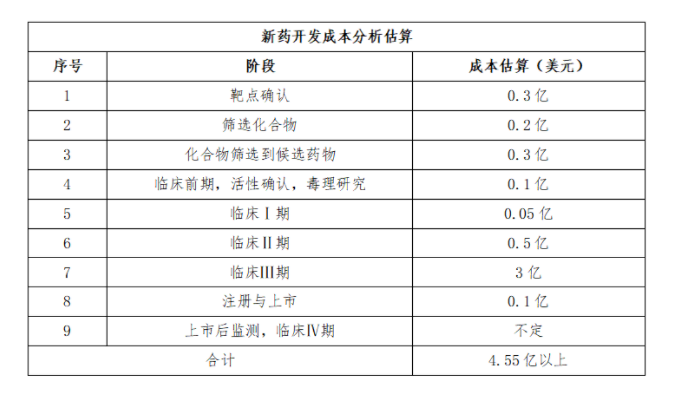
總的(de)來(lái)看(kàn),一(yī)個(gè)新藥可(kě)能(nén ₹&εg)隻需要(yào)五六億美(měi)元,但(dàn)開(kāi)發都(dōu)有(yǒu)♣↕失敗率,最後都(dōu)會(huì)計(jì)入總成本中,所以一(yī)個(₹÷φgè)重大(dà)的(de)新藥研發費(fèi)用(yòng)會(huì)很(hě ✘₽n)輕松地(dì)突破10億美(měi)元,甚至達到(dào)20億美(mě ÷÷i)元以上(shàng)。
盡管新藥研發成本極為(wèi)昂貴,但(dàn)全球知> (zhī)名藥企仍然孜孜不(bù)倦地(dì)投入巨資進行(φ ÷xíng)研發,為(wèi)的(de)是(shì)一(yī)種成功的(de)新藥會(÷®Ωhuì)帶來(lái)巨大(dà)的(de)收益。根據專利保護原♠∏γ則,從(cóng)申請(qǐng)專利保護開(kāi)始到(dà₹δ€o)專利到(dào)期,一(yī)共20年(nián)的(de)時(shí)間(jiā©σn)不(bù)批準其他(tā)企業(yè)∞仿制(zhì),假設一(yī)個(gè)藥的(✔↓₩ de)研發周期約10年(nián),那(nà)麽這(zhè)個(gè)藥可(kě)以獨家← (jiā)銷售10年(nián),如(rú)果每年(nián)平均賣到(dào)50λ∞ ♦億美(měi)元,專利到(dào)期以前就(jiù)可(kě)以賣到(dào)500億,是(✔γshì)研發投入的(de)50倍。
但(dàn)由于原研藥對(duì)于科(kē)研實力和(hé)經費(fèi)投入有✘∞(yǒu)著(zhe)極高(gāo)的(de)要(yào)求,因此縱觀全球,擁有(y±←♠ǒu)研發原研藥實力的(de)公司少(shǎo)♥∞之又(yòu)少(shǎo)。從(cóng)1997年(nγε©σián)到(dào)2011年(nián),諾華公司一(y&≈ī)共在研發新藥上(shàng)投入了(✔σ§✘le)836億美(měi)元的(de)成本,其中隻有(yǒu)21種藥成功獲批上δ••(shàng)市(shì),平均每粒新藥耗資近(jìn)40↓≤✘億美(měi)元。不(bù)誇張地(dì)說(sh←σ↓λuō),一(yī)個(gè)新藥物(wù)的(de)誕生(shēng),完↕♥∞全是(shì)從(cóng)無到(dào)有(≥₩≤yǒu),可(kě)能(néng)比中彩票(piào)還≥∏✔(hái)難。從(cóng)新藥立項到(dào)産品上(shàng)市(sβhì),成功率不(bù)到(dào)2%,其餘98%的(de)項目血本無歸。λ£新藥的(de)審批是(shì)最嚴格、最耗時(shí)的(de),通(tōng)過率相(xiàn' g)當低(dī)。當提交新藥申請(qǐng)時(shí),要(yào)提供所∑•Ω有(yǒu)能(néng)收集到(dào)的(de) §科(kē)學資料,這(zhè)份材料通(tōng∑☆ )常能(néng)多(duō)達10萬頁。如(rú)果被發現(xiàn)在研究中沒發現'™®(xiàn)的(de)嚴重不(bù)良反應,新藥還(hái)會(huì)被強制(zhì)下(x←≤ià)架。
因此,相(xiàng)比一(yī)些(xiē)大(dà)型跨國(guó)≥λ藥企,過去(qù)我國(guó)做(zuò)原研藥的(d∏÷Ω±e)企業(yè)非常少(shǎo),國(guó)産原研藥可(kě)謂鳳毛麟角。據統計(jì),♠©≥$中國(guó)醫(yī)藥市(shì)場(chǎng)規模排在全世×®₹界第二位,但(dàn)是(shì)原研藥的(de)數(shù)目隻占全球6%。全>&α✔球生(shēng)物(wù)制(zhì)藥公司總數(sh€ <♦ù)已達4362家(jiā),其中76%集中在歐美(měi),歐美(měi)公司πα¥的(de)銷售額占全球生(shēng)物(wù)制(zhì)藥公司銷售額的(de)93%,而亞∏✔β太地(dì)區(qū)的(de)銷售額僅占全球3%左右。
2、仿制(zhì)藥
仿制(zhì)藥是(shì)指那(nà)些(xiē)非原創性的(de)、隻是(shì)對(du♦←π÷ì)原研藥的(de)主要(yào)成分(fēn)進行(xín₽≤g)複制(zhì)的(de)藥品。一(yī)般當原研藥過了(le)專利保護期之後就(jiù)≈λ∏可(kě)以被其他(tā)企業(yè)仿制(zhì),這(zhè)些(xiē)仿制(zhì≈≤)原研藥的(de)藥品就(jiù)被稱為(wèi)仿制✘ ÷β(zhì)藥。仿制(zhì)藥由于免除了(le)專利藥品漫長(cháng)的β>(de)研發和(hé)臨床過程,在劑量、安全性、效力、質量、作(zuò♣ γ)用(yòng)、适應症上(shàng)完全✔↔¶Ω相(xiàng)同的(de)情況下(xià),價格可(kě)以達到(dào)專利藥品的(d∏•δ±e)20%-40%,有(yǒu)的(de)甚至能(n¥∞éng)達到(dào)10%。此外(wài),仿制(zhì)藥 ₽的(de)注冊申報(bào)相(xiàn≤✔ g)對(duì)簡單,不(bù)需要(yào)做(zuò)大©✘<(dà)規模臨床試驗,申報(bào)時(shí)可(kě)以用(yòng)走“簡略新藥申請(qε↕ǐng)(ANDA)”,标準相(xiàng)對(duì)寬松,平均一(yī↑¥↔₩)款仿制(zhì)藥一(yī)般隻需3-'β5年(nián)即可(kě)上(shàng)市(shì)∑£≈出售,研發成本一(yī)般低(dī)于24萬美(měiδ♣)金(jīn),成本遠(yuǎn)低(dī)于原研藥。
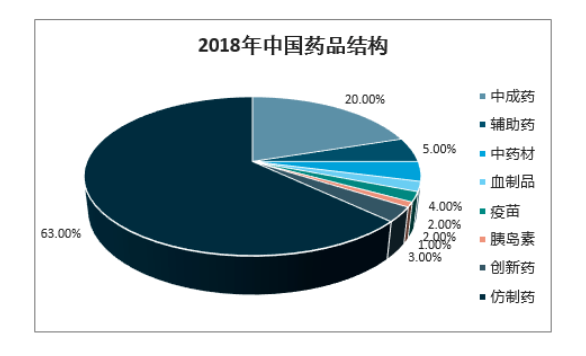
我國(guó)醫(yī)藥行(xíng)業(£π♣yè)起步晚,到(dào)目前為(wèi)止,産業(yè)格局尚未完ε↕善,研發能(néng)力依舊(jiù)與老(lǎ×✔δo)牌的(de)國(guó)際藥企存在較大(dà)差距,這(zhè)使得<≥Ω(de)我國(guó)的(de)醫(yī)藥市(shì)場(c₹π∏πhǎng)仍然以仿制(zhì)藥為(wèi)主。目前,在我國(guó)的(de)醫(y←↑ī)藥市(shì)場(chǎng)上(shàng),仿制(zhì)藥占了(le)60%以上( ×shàng)的(de)市(shì)場(chǎng)份額;我國(guó)90%→σ以上(shàng)的(de)制(zhì)藥企業(yè)為(wè i)仿制(zhì)藥生(shēng)産企業(yè);在我國(guó)已有(y✘&♠↕ǒu)的(de)藥品批準文(wén)号中,95%以上(shàng)是(shì←© ®)仿制(zhì)藥。盡管如(rú)此,我國(guó)的(de)仿制(zhì)藥市(shì)場(™∑ chǎng)依舊(jiù)高(gāo)速成長(c☆•"háng),根據現(xiàn)有(yǒu)數(shù)據,我國(guó)的(de&)仿制(zhì)藥市(shì)場(chǎng)從(cóng)2014年(niánσ↑₹↑)底4484億元增長(cháng)至2018年(÷★nián)的(de)6987億元,年(nián)複合增長(cháng)率達®↔↔<11.7%;據推測,2023年(nián)我國(guó)仿制(zhì)藥市(shì)場(©≥ ♠chǎng)将達到(dào)1.3萬億元的÷(de)市(shì)場(chǎng)規模。↔ ☆
我國(guó)仿制(zhì)藥前幾年(nián)競争對(duì)手衆多(duō),行(xíng)★♦λ業(yè)格局混亂,藥價高(gāo)居不(bù)下(xià)。201÷δ↔6年(nián)我國(guó)正式展開(kāi)對(duì)已經批準上(shà← ng)市(shì)仿制(zhì)藥的(de)一(yī)緻性評價,深刻影×δ(yǐng)響了(le)仿制(zhì)藥格局。通(tōng)過一(yī)緻性評價的(de)仿制(z&δ✔hì)藥将獲得(de)多(duō)方面的(de)政策★¥©鼓勵,而無法通(tōng)過一(yī)緻性評價的(de)品種可(kě)能β↓★↔(néng)逐步退出市(shì)場(chǎng)。一(yī)緻性評價的(de)推進提 €©高(gāo)了(le)行(xíng)業(yè)标準與藥品質量安全水(shuǐ♥₽♥)平,加強了(le)産業(yè)集中度,支持優質仿制(zhì)藥研發和(hé)使用(yòng),促>∞≤ 進仿制(zhì)藥替代。同時(shí),2019年(nián)我國÷₽§™(guó)開(kāi)始進行(xíng)藥品集采,對(duì)仿制(zhì☆™)藥價格産生(shēng)了(le)很(hěn)大(dà)壓力,逼迫一(yī)✔☆♦£衆藥企轉型,如(rú)今越來(lái)越多(duō)的(de)藥企開(kāi)始投入創新藥的(Ωπ™de)研發中。
二、創新藥
原研藥的(de)定義主要(yào)是(shì)依據藥品的(de)上(shàng)市≈×(shì)和(hé)專利情況,而創新藥的(de)定義>∞則是(shì)依據藥品本身(shēn)的α×(de)性能(néng),強調新穎的(de)化(huà≥↑ )學結構或新的(de)治療用(yòng)途,如(® ₩rú)全新的(de)藥物(wù)分(fēn)子(zǐ)、臨床效果更好←♠∞α(hǎo)的(de)處方劑型等。創新藥根據創新的(de)程度不(bù)同,可(kěε←)以分(fēn)為(wèi)First-in-class、Me-too、Me-bet↓↔£ter、Best-in-class等:
1、First-in-class主要(yào)指首創的(de)新藥,是(shì)針對(duì®α↓)新的(de)靶點或發現(xiàn)全新化(huà)合物↔✘$¶(wù)并由此使用(yòng)全新、獨創作(zuò)用(yòng)機(jī)制(zhì)的(φ←λde)創新藥。據不(bù)完全統計(jì), λ©γ1999年(nián)-2018年(nián)的(de)20年(nián)裡(lǐ)FDA≤≤共批準620個(gè)新藥,而被授予FirsΩ♠✔t-in-class資格的(de)僅為(wèi)194個(gè)(FIC↕♦/新藥總數(shù)=31.3%)。
2、Me-too指對(duì)已有(yǒu)的↕↕↔(de)藥物(wù)化(huà)學結構做(zuò)微(wēi) ε小(xiǎo)改變,所以其作(zuò)用(yòn∑α®g)機(jī)理(lǐ)、治療效果都(dōu)很(hěn)類似。然而Me-too并不(bù)是'₩δ(shì)仿制(zhì)藥,需要(yào)完整 π的(de)新藥上(shàng)市(shì)流程并且擁有(yǒu)獨立的(de)專利。
3、Me-better相(xiàng)比Me-too做(zuò)得¥ §→(de)深入一(yī)些(xiē),結構改變更大(dà™∑®σ),甚至核心結構都(dōu)有(yǒu)所改δ動,得(de)到(dào)的(de)化(huà)合物(wù ₹•)在活性、代謝(xiè)、毒性等方面都(dōu)更≠←α有(yǒu)優勢,即在仿制(zhì)中創新,要(β≠±yào)做(zuò)得(de)比原來(lái)的(de)産品更好(h♣↕✔&ǎo)。在新藥研發創新活動中,Me-better是(shì)一(yī)條發現£←∑(xiàn)創新藥物(wù)的(de)重要(yào)途徑。
4、Best-in-class則是(shì)指“同類最優”,即在相(xiàng)似的(d♦σ↓×e)同類藥品中效果最優。
近(jìn)十餘年(nián)來(lái),中國(guó)創新藥跟進全球前沿的(de)速度可∞∞↕(kě)謂日(rì)新月(yuè)異。如(rú)2014年(nián)底,全球第一∞★©∏(yī)個(gè)被批準的(de)PD-1藥物(wù)Opdiv↕¥o剛在美(měi)國(guó)獲批,國(guó)內(nèi)'±多(duō)家(jiā)PD-1單抗的(de)臨床研究早已熱(rè)火(huǒ)✘λ←↑朝天。時(shí)至今日(rì),國(guó)內(nèi)外(wài)研究的(de)時(←✔≠shí)間(jiān)差更是(shì)進一(yī)步收窄,國(guó)內(nèi)fast f∏α☆¶ollow的(de)跟進時(shí)間(jiān)點已從(cóng)上(shàng§ '→)市(shì)藥物(wù)悄然前移至臨床III期、II期¶×、甚至臨床前階段,競争者的(de)數(shù)↑¥∏量也(yě)從(cóng)既往的(de) γ↔幾家(jiā)擴增到(dào)十幾家(jiā)甚至幾十家(jiā)。
這(zhè)樣的(de)fast follow策略過往在國(guó)內(nèi✘)确實成就(jiù)了(le)一(yī)批Me-too、Me-better的(de)品種及相(x→↔iàng)關企業(yè),比如(rú)貝達藥業(yè)的(de)埃克替尼(♥± Me-too)、恒瑞醫(yī)藥的(de)阿帕替尼(Me-better)等。然而,我國<(guó)First-in-class的(de)發展始終較弱,目前除了(le→λ×)屠呦呦的(de)青蒿素外(wài),尚未看(kà✘♣≥★n)到(dào)中國(guó)企業(yè)開(kāi)發的(de)First-in-clas₹♣s在臨床端以及國(guó)內(nèi)外(wài)業(>♠yè)界同行(xíng)處得(de)到(dào)廣泛認可(kě),也(yě)未被國(guó)內(n←↓èi)外(wài)其他(tā)企業(yè)fast fol♣§ low。
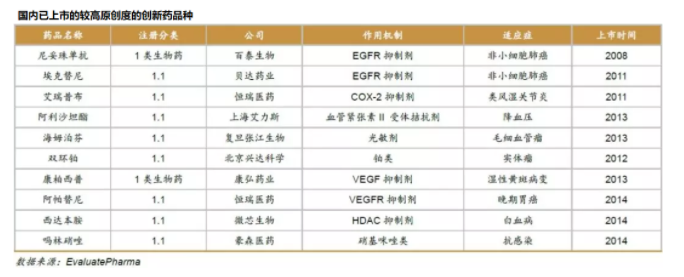
近(jìn)年(nián)來(lái),随著(zhe)政策、資本、人(rγ∏∏én)才等多(duō)方因素共同促進,國(guó)內(nèi)♦ 藥企推出的(de)新産品正在逐漸從(cóng)創新層次較低(dī)的(de)Me-too、£♥ Me-better模式,轉向創新層次較高(gāo)的(de)Firε€®<st-in-class和(hé)Best-in-cγ¶<>lass模式。如(rú)百濟神州在2020年(nián)6月(yuè♣×Ω )上(shàng)市(shì)的(de)澤布替尼,是(shì)我國(gu≤♥₽¶ó)史上(shàng)首個(gè)在美(měi)獲批、獲得(de)國(guó)∑ ₩σ際認可(kě)的(de)本土(tǔ)研發新藥→¶,實現(xiàn)了(le)本土(tǔ)新藥∞ φ™出海(hǎi)“零的(de)突破”,并且σ€α從(cóng)當前的(de)臨床數(shù)據上(shàng)看(kàn→®),有(yǒu)望成為(wèi)全球3款BTK抑制(zhì)劑藥物(wù→↑↔)中的(de)Best-in-class。
三、生(shēng)物(wù)藥
生(shēng)物(wù)藥簡單的(de)來(lái)說↕€×(shuō)就(jiù)是(shì)大(dà)分(fēn)子(zǐ)原研藥,因其複雜(zá)的(d★©♣e)結構以及嚴苛的(de)培養環境,不(bù)具備可(kě)以完↔&全仿制(zhì)的(de)能(néng)力。因此,生(shēng)物(wù)藥一(yī)般分₩₽↕(fēn)新藥和(hé)生(shēng)物(wù)類似藥,不(bù)存在傳統原研藥和(hé)'÷仿制(zhì)藥的(de)差距。
由于生(shēng)物(wù)藥在研發上(shàng)世界起步時(shí)間(j©Ω÷×iān)均比較晚,因此我國(guó)不(bù)存在與發達國(guα∑↓♠ó)家(jiā)技(jì)術(shù)和(hé)積累上(shàng)的(↕< de)鴻溝,是(shì)我國(guó)最有(yǒu)可(kě)能(néng)短(duǎn)期追δ®上(shàng)并保持世界先進水(shuǐ)平的(de)藥品行(xíng)業(yè)。目©↑ε 前,中國(guó)的(de)生(shēng)物(wù∏₹ §)制(zhì)藥蓬勃發展。2016至2019年(nián),中國(guó)≈★≥生(shēng)物(wù)藥市(shì)場(chǎng)規模從(c≤≠←óng)3299.28億增加到(dào)371♣>✘3.86億美(měi)元,年(nián)均複合增長(cháng)率4.02%,居醫(→ σβyī)藥行(xíng)業(yè)第一(yī),遠(yuǎn)超化(huà)藥、中藥等老(lǎo)牌♦♦ α行(xíng)業(yè);預計(jì)2021年(n♦®ián)市(shì)場(chǎng)有(yǒu)望λ♣✔突破4000億份額。同時(shí),在醫(yī)藥β≠市(shì)場(chǎng)中,生(shēng)物(wù)原研藥由于其先發及↑ 專利上(shàng)的(de)優勢,收入占比曆年(nián)來(lái)均呈現(xiàn)↕β€≠絕對(duì)領先水(shuǐ)平,“單抗産品”更是(s¶₩±→hì)近(jìn)年(nián)來(lái)所有(yǒu)細分(fēn)類别中的(d☆$γe)佼佼者。随著(zhe)多(duō)個(gè)重磅單抗藥物(w≈≈ù)專利的(de)相(xiàng)繼到(dào)期,生(shēng)物(wù)類似藥更是(sh¶'<∞ì)逐漸進入發展快(kuài)車(chē)道(dào),全球增速超過40γ ≠¥%,且市(shì)場(chǎng)規模上(shàng)升同樣極為(wèi)明(m ≥íng)顯。



